摘要 [摘 要] 纤维素分解菌可用于动物微生态添加剂和除臭剂。此试验采用羧甲基纤维素平板法及刚果红染色法,从鹅的粪便中初步分离筛选出7株能够降解纤维素的细菌,结合摇瓶发酵法进
[摘 要] 纤维素分解菌可用于动物微生态添加剂和除臭剂。此试验采用羧甲基纤维素平板法及刚果红染色法,从鹅的粪便中初步分离筛选出7株能够降解纤维素的细菌,结合摇瓶发酵法进行复筛,最终选出3株羧甲基纤维素酶活性高的菌株,并对其进行形态学和16SrRNA 鉴定。结果表明:3株纤维素分解菌的菌落形态不一,但其表面均微粗糙,革兰氏染色均呈阳性,短杆状或细杆状,有芽孢;结合16SrRNA 鉴定结果,最终将分离到3个菌株鉴定为芽孢杆菌属的地衣芽孢杆菌、蜡样芽孢杆菌和沙福芽孢杆菌,分别命名为 BacilluslicheniformisG-1、BacilluscereusG-4和BacillussafensisG-10。
[关键词] 粪便;纤维素分解菌;分离筛选;鉴定
纤维素是地球上最丰富且廉价的可再生资源,但因其具有水不溶性的、高结晶的结构而难以被人们利用[1]。目前,纤 维 素 主 要 应 用 在 燃 料 制 作、堆肥、造纸行业以及动物饲料方面,不仅利用率低,而且环境污染大[2]。因此,如何通过生物学方 法 有 效提高纤维素资源的利用效率、减少环境污染已成为研究的热点。自然界中能够对结构复杂的纤维素进行有效降解的微生物主要有真菌、细菌和放线菌。真菌因其分泌的纤维素酶系成分全面、酶量大、活性高、对纤维降解能力强,已被应用于酶制剂的生 产[3]。细菌则具有培养简单、生长速度快、发酵周期短、耐高温等优点。许多能够高效降解纤维素的细菌已从不同环境中被分离筛选出来[4-6],并作为益生菌和生物发酵菌剂被广泛研究和应用。如黄旺洲[7]将高效纤维素分解菌用于猪粪和牛粪的堆肥发酵,发现粪便中的粗纤维和有机质被有力地分解和降解,从而使粪便中的 NH3 及 H2S的释放也得到了抑制;何 伟 聪等[8]发现,枯草芽孢杆菌以及嗜酸乳杆菌的单一菌剂或其混合菌剂均能促进幼鱼生长以及提高免疫酶和消化酶的活性。此外,王永芬等[9]和戴求仲等[10]也在研究中发现,产纤维素的芽孢杆菌属细菌作为单一菌剂和复合菌剂均能促进鸡生长和生产性能,并对鸡肠道微生物菌群有一定影响。鹅是草食性动物,能够有效利用粗纤维,这主要是由于在其空肠后段、回肠和盲肠内存在大量能够降解纤维素 的 微 生 物[11]。本研究旨在从鹅的新鲜粪便中分离筛选出能够高效分解纤维素的细菌,为纤维素酶的生产、益生菌的开发和生物堆肥提供菌种资源。
1 材料与方法
1.1 试验材料
1.1.1 样品采集 本试验中所用的鹅的新鲜粪便采集于洛阳师范学院伊滨校区月明湖畔。采集粪便时,除去其表面的杂草和泥土,取中间部分,装封口塑料袋中,排气封口,编号,放入干净的泡沫盒中迅速带回实验室并进行细菌的分离。
1.1.2 培 养 基 配 制[5] 羧 甲 基 纤 维 素 钠 (CMC-Na)10.0g,蛋白 胨 5.0g,酵母 粉0.5g,K2HPO41.5g,MgSO4·7H2O0.2g,氯化钠 5.0g,琼脂粉16.0g,蒸馏水定容至1000mL。基础发酵培养基:蛋白胨10.0g,酵母粉5.0g,氯化 钠 10.0g,CMC-Na10.0g,蒸 馏 水 定 容 至1000mL,固体培养基需加入琼脂16.0g。LB培养基:蛋白胨10.0g,酵母粉5.0g,氯化钠10.0g,蒸馏水定容至1000mL,固体培养基需加入琼脂16.0g。所有培养基调 pH 至7.2,121 ℃高压 蒸 汽 灭菌30min。
1.1.3 试剂与仪器 胰蛋白胨、酵母提取物、琼脂粉购自 Oxoid公司;革兰氏染色试剂盒购自北京陆桥技术股份有限公司;2×PCR MasterMix、MarkerIII购自北 京 天 根 生 化 科 技 有 限 公 司;Goldview 购自 北京白浩生物公司;十六烷基三甲基溴化铵(CTAB)、3,5-二硝基水杨酸(DNS)、CMC-Na、酒石酸钾钠、苯酚、十二烷基硫酸钠(SDS)、葡萄糖、刚果红、异戊醇、氯仿、异丙醇、乙醇等试剂均为国产分析纯产品。主 要 仪 器 有:BIO-TEK Synergy H1 型 酶 标仪、莱 卡 正 置 荧 光 显 微 镜、台 式 高 速 冷 冻 离 心 机、EppendorfPCR 扩增 仪、JA2003A 型电 子 天 平、恒温培养箱、电泳仪、凝胶成像分析仪、高压蒸气灭菌锅等。
1.2 方法
1.2.1 纤维素 分 解 菌 的 初 筛 称 取 鹅 粪 便1.0g,加入无菌水至100mL,在80 ℃恒温水浴锅中振荡30min,即得100倍的粪便内容物稀释,然后再继续进行梯度稀释。分别取不同梯度的100μL 样品稀释液涂于 LB+1%CMC 平板上,于37 ℃恒温培养箱中培养48h,向培养皿 中 加 入 适 量0.1%刚果 红溶液染 色 1h 后 弃 去 染 液,再 加 入 适 量 1 mol/LNaCL溶液洗涤[12]。测量平板上菌落周围透明水解圈的直径(D)和菌落直径(d),选择 D/d比值大的菌落接种至 LB液体培养基中培养,并在 CMC平板上反复划线分离纯化培养2~3代,得到纯化的纤维素分解菌菌种,将其转至斜面 LB固体培养基培养后,4 ℃保存备用。
1.2.2 纤维素分解菌的复筛 将初筛到的纯化的纤维素分解菌菌液浓度调整至 OD600=0.5,然后按1%接种量接种于基础发酵培养基中,37 ℃ 160r/min振荡培养28h,5000r/min、4℃离心发酵液15min,上清液即 为 粗 酶 液,以羧甲基纤维素酶(CM-Case)活性高低作为复筛纤维素分解菌的标准。CMCase 活 力 的 测 定 参 照 《NY/T 912 -2004》[13]方法 进 行。其 中,CMCase的 酶 活 力 单 位定义为:CMCase与底物 CMC-Na在 pH5.5、40 ℃ 条件下反应30min,每分钟由底物 CMC-Na降解产生1μmol还原糖所需的酶量,用 U/mL表示。
1.2.3 纤维素分解菌的鉴定方法
1.2.3.1 形态学鉴定 观 察 细 菌 在 CMC 平板 上的生长状况,包括形状、形态、颜色、透明度等。同时采用革兰氏染色法[14]观察并记录培养24h时菌体在显微镜下形态和染色特征。
1.2.3.2 纤维素分解菌的16SrRNA 基因鉴定细菌基因组 DNA 的提取采用 CTAB/NaCL 法[15]。以细菌基因组 DNA 为模板,采用细菌通用引物(上游引 物 27F:5'-AGAGTTTGATCCTGGCTCA-3',下 游 引 物 1492R: 5 '-GGTTACCTTGT-TACGACTT-3')[16]进行细菌16SrRNA 基因扩增。PCR反应体系(25μL)如下:DNA 模板1μL(50~100ng/μL),上下 游 引 物 各1μL,2×PCR MasterMix12.5μL,无离子水补足25μL。PCR 程序为:95℃3min;94℃30s,55℃30s,72℃50s,30个循环;72 ℃延伸5min。1.0%琼脂糖凝胶电泳检测目的基因。北京中科希林生物科技有限责任公司进行测序。测 序 结 果 在 NCBI上 用 BLAST 程 序 与GenBank中16SrRNA 基因序列进行同源性分析。用 Mega6.0中的邻接法(Neighbor-joining)构建系统发育树。
2 结果与分析
2.1 纤维素分解菌的初筛
将鹅粪便稀释液涂布于含 CMC-Na的培 养 基平板上培养并径刚果红染色,发现有11株菌的菌落周围产生清晰的透明水解圈。进一步将初筛到菌株反复划线纯化培养,通过比较不同菌株菌落的形态和大小以及刚果红染色后所产生的透明圈和菌落直径比值的大小后,最终确定3种不同菌落形态特征共7株菌用于复筛(表1)。
2.2 菌株的复筛
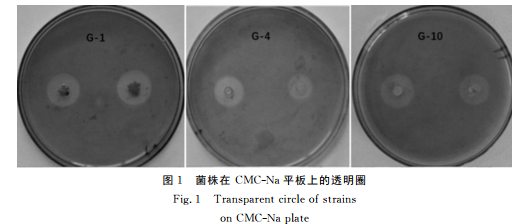
分别将3种不同菌落形态特征的7株菌进行摇瓶发酵培 养,根据各菌株在发酵至 28h 时 的 CM-Case活性(表1),确定将 菌 落 类 型I以 及 菌 落 类 型II和III中 CMCase活性最大的菌株 G-1、G-4和 G-10用于后续研究(图1)。
2.3 菌株的形态学特征
通过形态学研究发现,在 LB固体培养基上,G-1菌株的菌落 扁 平,表 面 粗 糙,不 规 则,灰 白 色 略 带粉色;G-4为圆形或近似圆形、质地软、有些菌 落 表面稍微粗糙的、白色稍有光泽;G-10菌株的菌 落 为圆形、边缘光 滑 的 白 色 大 菌 落,其 表 面 也 稍 微 粗 糙(图2)。3株菌株革兰氏染色均为阳性,杆状,有芽孢(图3)。
2.4 菌株的分子学鉴定
采用0.8%琼脂糖凝胶电泳检测提取的各菌株基因组 DNA,发现各菌株基因 组 DNA 大小 都 在7000bp以上,且 条 带 明 显 有 拖 尾 现 象,说 明 有 一 定的降解(图4)。然后以各菌株基因组 DNA 为模板,利用细菌通用引物进行 PCR 扩增,1.0%的琼脂糖凝胶电泳检测,分 别 得 到 了1500bp的目 的 条 带,其大小与预期结果基本一致(图5)。
测序 结 果 显 示,G-1,G-4 和 G-10 菌株 的 16SrRNA 基因长度分别为1440bp、1453bp和1461bp,与预期 结 果 相 符。在 NCBI上用 BLAST 程序对各菌株的16SrRNA 基因测序结果进行比对和同源性分析,以及从 Mega6.0构建的系统进化树,发现这3株细菌均为芽孢杆菌属细菌,其中 G-1为地衣芽孢杆菌,G-4为蜡 样 芽 孢 杆 菌,G-10为沙 福 芽孢杆菌。结合各菌株的16SrRNA 基因分子学鉴定结果及形态学鉴定和革兰氏染色结果,最终确定该G-1菌 株 为 芽 孢 杆 菌 属 的 地 衣 芽 孢 杆 菌,命 名 为BacilluslicheniformisG-1;G-4菌株为芽孢杆菌属的蜡样芽孢杆菌,命名为 BacilluscereusG-4;G-10为芽孢杆菌属的沙福芽孢杆菌,命 名 为 BacillussafensisG-10。
3 讨 论
几种纤维素分解菌分离筛选的方法中,均是以CMC-Na为唯一碳源进行筛选,如Lee等[17]采用的是在 LB培养中添加 CMC-Na和台盼蓝来进行分离,而 Kasana等[18]采用在 LB培养基中添加 CMC-Na和革兰氏碘液来进行分离,但 LB培养基中添加CMC-Na作为唯一碳源进行纤维素分解菌的分离培养,然后采用刚 果 红 染 色,根 据 D/d值 的 大 小 来 初步筛选纤维素分解菌,该法因简单快捷、成本低等优点,从而被很多研究者广泛采用[19]。但 CMC-Na平板筛选法不能准确定量反映菌株产纤维素酶能力的高低,因此需要进一步将初筛到的菌株进行液体发酵,根据其纤维素酶活的高低进行复筛[20]。试验初期,我们初筛到了在 CMC-Na平板上菌落透明圈直径和菌落直径比值大的3类形态不同的7株能够分解纤维素的细菌,由此可见这与鹅的粗纤维饮食有一定的关系。细菌种属间由于生理生化特征极其相似,单凭传统的表型和生理生化鉴定无法准确对其进行分类鉴定。随着基因测序技术和数据分析方法的不断进步,细菌的分类鉴定也演变到了分子水平。目前,将16SrRNA 基因作为分子标志物用于细菌种属的鉴定,使鉴定结果更加快速、准确和可靠[21-22]。结合试验中3株 CMCase酶活较高细菌的表型特征,以及它们的16SrRNA 基因序列与 NCBI数据库中大量细菌的16SrRNA 基因序列比对分析,发现它们均属于芽孢杆菌属细菌,其中 G-1被鉴定 为 Bacilluslicheniformis,G-4被鉴 定 为 Bacilluscereus,G-10被鉴定为Bacillussafensis。
BacilluslicheniformisG-1、BacilluscereusG-4及BacillussafensisG-10菌株在基础发酵培养基中发 酵 培 养 28h 时的 CMCase活性 分 别 为 0.1、0.18和0.25U/mL,与张盼等[4]、易旻等[23]分离出来的纤维素分解菌的CMCase活性差别很大。分析发现,影响纤维素分解菌 CMCase活性的因素不仅与菌种及其来源环境、培养基成分、发酵培养时间等因素有关外,还与纤维素酶的测定方法及酶反应条件等因素有关。测定纤维素酶的方法很多。在试验中,不 同 使用者往往根据自己的试验目的选用不同的测定方法,并据各自的经验对试验条件和步骤做部分修改,所以使得测定方法更加多样化,以致于各研究者的试验研究结果没有可比性[24],这些不足也给纤维素酶的开发利用带来了很多不利的影响。此外,酶反应条件如反应的pH、反应温度及时间、底物和酶液的浓度 等 也 是 影 响 CMCase活 性 的 主 要 因 素[25]。本试验中,纤维素分解菌酶活力的测定是按照中国农业部行 业 标 准《NY/T912-2004》[13],即在 pH5.5、40 ℃条件下,反应30min进行的,发酵用的是最基础的 LB+1%CMC培养基,这也是造成 CMCase酶活低 的 主 要 原 因。后 期 我 们 将 继 续 对 Bacilluslicheniformis G-1、BacilluscereusG-4及 BacillussafensisG-10的纤维素酶的酶学特性进行研究,并对其培养基进行优化,以使其体现出最佳的产酶条件;此外,还要研究它们的抗逆特性以及在粪便堆肥发酵过程中的降氨和除硫效果,为纤维素分解菌的合理开发利用提供科学参考依据。
4 结 论
我们从鹅粪便中分离筛选到了3株能高效降解纤维素的细菌,它们均为革兰氏染色阳性,短杆状或细杆状,有 芽 孢;结 合 16SrRNA 基因分子鉴定结果,最终确定其分别为芽孢杆菌属的地衣芽孢杆菌、蜡样芽孢杆菌和沙福芽孢杆菌。
参考文献:
[1] LYNDLR,LASER MS,BRANDSBYD,etal.Howbiotechcantransformbiofuels[J].NatBiotechnol,2008,26(2):169-172.
[2] 黄国欣,梁自超,孙瑞涛,等.纤维素分解菌在反刍动物生产中的应用研究[J].中国奶牛,2017,35(4):5-8.
[3] 熊冬梅,周 红 丽.纤维素降解菌群的研究进展[J].酿 酒 科 技,2011,32(5):94-97.
[4] 张盼,刘婉瑜,李晓秀,等.高效纤维素优势分解菌的筛选和鉴定[J].中国土壤与肥料,2017,54(2):149-156.
动物粪便中纤维素分解菌的分离和鉴定相关论文期刊你还可以了解:《微生态方面论文发表》
转载请注明来自:http://www.lunwenhr.com/hrlwfw/hrnylw/11398.html