摘要 摘要:食品中的可卡因不易被察觉,为分析运动营养食品的安全性。本文采用液-液萃取-气相色谱法检测尿液和血液中的可卡因,将待检测的人体尿液和血液生物样本进行预处理,优化
摘要:食品中的违禁药品不易被察觉,为分析运动营养食品的安全性。本文采用液-液萃取-气相色谱法检测尿液和血液中的违禁药品,将待检测的人体尿液和血液生物样本进行预处理,优化液-液萃取条件后,采用 GC-FID 方法获取检测尿液和血液在不同条件下的色谱图。实验结果表明,色谱图显示检测尿液中的 COC 和检测血液中的 COC、EME 与基体干扰的分离效果明显;随着加入违禁药品标准溶液质量浓度的提升,检测尿液和血液中的违禁药品平均回收率越高,最高平均回收率分别是 96.73%和 98.43%,且平均最小相对标准偏差是 1.39%,人体食用运动营养食品后日内和日间血液中 EME 和 COD 的平均相对标准偏差均低于 2.3%,说明该方法可准确检测出食用运动营养食品后人体尿液和血液中的违禁药品,从而判定运动营养食品的安全性。
关键词:运动营养食品;违禁药品;液-液萃取;气相色谱;检测方法;尿液;血液
随着经济的发展,人们的生活不断提高[1],越来越多的人们开始关注运动以及营养问题。运动营养食品是含有很高营养素的一类食品,对于运动人员该类产品能够很好的补给身体所消耗的能量,与一些普通的营养保健产品相比其效果显著。我国在运动营养食品方面的认知较其他发达国家晚,但随着人们运动观念的增强,运动营养食品迅速发展[2],运动营养食品能否健康发展成为人们担忧的问题。对运动营养食品的检测备受关注,尤其是一些违禁品,比如违禁药品(cocaine,简称 COC),其在医学领域中的麻醉药、血管收缩剂方面起到很好的作用,但是其毒性特别强,身体注射方面避免使用[3]。当食用少量的违禁药品食品时能够提高人们的情绪、消除疲劳,主要是因为它能够使人体的神经中枢局部麻醉,但是过量摄入含违禁药品食品时,会损伤人体消化系统、心血系统和泌尿生殖系统等,对人体造成严重损害,因此,需要对运动营养食品中的违禁药品进行检测。
通常选取甲基替换芽子碱的羧基氢作为违禁药品的生物检材,羰基苯基替换羟基氢后生成的一种双酯型生物碱,即为违禁药品。违禁药品可以通过呼吸道以及消化道的粘膜被人体吸收[4],在人体内代谢循环。违禁药品的半衰期是不一样的,可以通过其被人体吸收的方式判定[5],但基本上都是通过肝脏代谢得到其分解因子,主要因子为苯甲酰芽子碱、爱冈宁甲基酯。通常被用作检测违禁药品的生物检材为尿液和血液,当然,唾液、毛发、皮肤和指甲等等其他身体组织也可作为检测违禁药品和其代谢物的检测检材。检测出的信息情况会根据不同生物检材给出不同的结果。当收集到血液、尿液生物检测材后,必须在目标成分的检测及提取之前对其进行预处理。利用离心技术将血液分离[6],选用上层的清液,采用该清液检测及提取违禁药品等其他禁用物质。利用酸解和酶解法将违禁药品等禁用物质的本身或代谢因子从尿液中分离出[7]。液-液萃取(Liquid-Liquid Extraction,简称 LLE)和气相色谱法 GC(Gas Chromatography)是检测和提取血液、尿液生物检材中违禁药品的主要方法。本文通过液-液萃取-气相色谱法检测尿液和血液中的违禁药品方法,检测人们食用运动营养食品后代谢的违禁药品及其代谢物爱冈宁甲基酯(ecgonine methyl este,简称 EME),为分析运动营养食品的安全性和违禁药品滥用现象提供可靠的依据。
1 材料与方法
1.1 仪器和试剂
美国 Agilent 公司生产的氢火焰离子化检测器和 7890N 气 相 色 谱 仪 ; 德 国 Sigma 公 司 生 产 的 Sigma3K15 高速冷冻离心机,柱体为 30 m×0.32 mmi.d×0.25 μm 的 HP-5 弹性石英毛细管柱;来自北京八方世纪科技有限公司的 BF2000-A 氮气吹干仪以及日本 SHimadzu 公司的 QP-2010 型气相色谱-质谱仪。盐酸违禁药品(C17H21NO4·HCl=339.86)标准品(国家麻醉药品实验室);从美国 Fisher 公司购买的甲醇(色谱纯);分析纯是酸乙酯、环己烷、氯仿、浓盐酸以及氢氧化钠等,检测尿液和血液均来自一名食用某运动营养食品的健康志愿者。
1.2 实验方法
1.2.1 调制标准溶液
将 2.0 mL 的甲醇添加到装有盐酸违禁药品的容量瓶(3.0 mL)中,待其彻底溶解后稀释定容到 3.0 mL,基于游离碱算法,搅拌均匀调制成 4 mg/mL 浓度的标准备用液,置于-20 ℃环境中,并且密闭保存[8]。然后稀释标准备用液,稀释到 120 μg/mL,作为待使用的标准溶液。
1.2.2 色谱分析条件
1.2.2.1 检测尿液
柱温利用程序升温:200 ℃保持 1 min,首先以 20 ℃/min 作为标准,将温度升高至 250 ℃,并将此温度持续 5 min;然后以 30 ℃/min 作为标准,将温度升高至 300 ℃,并将此温度持续 8 min。通过以上升温过程,使得进样口和检测器温度均为 300 ℃;载气:高纯氮恒流 5.0 mL/min,燃气;氢气流量:50 mL/min;尾吹气流量 30 mL/min。进样品体积是 2.0 μL,风流比为 15:1。
1.2.2.2 检测血液
色谱柱体为30 m×0.32 mm×0.25 μm 的 HP-5 弹性石英毛细管柱,利用程序将其温度升高:当温度在 120 ℃以下时,持续 2 min,然后以 8 ℃/min 的速率将温度提高至 160 ℃;以 16 ℃/min 速率将温度提高至 260 ℃,持续 5 min;以 35 ℃/min 速率将温度升高至 300 ℃,持续 8 min。设定 300 ℃为进样口和检测器温度;载气:纯度高的氮气,持续流出 4.0 mL/min;燃气:氢气,以 45 mL/min 流出,尾吹气以 50 mL/min 流出。进样体积是 2 μL,分流比是 15:1。
1.2.3 样品预处理
处理尿液样品:将 60 μL,100 μg/mL 的违禁药品标准溶液添加到装有精确吸取的 2 mL 检测尿液的具塞维形瓶(50 mL)中,混合均匀,放置 25 min 后添加 2 mL 浓度为 0.05 mol/L,pH 9.5 的碳酸钠(Na2CO3) -碳酸氢钠(NaHCO3)缓冲溶液。添加 8 mL 试剂,在温度为 40 ℃时利用水浴震荡提取 10 min。提取有机相,温度 40 ℃下利用氮气吹干,通过甲醇将残渣溶解,定容到 100 μL,提取 2 μL 进样 GC-FID 测定[9]。处理血液样品:将 35 μL 的标准溶液添加到装有精确吸取的 2 mL 检测血液的微波样品罐中,混合均匀[10],放置 35 min 后添加 2 mL 采用碳酸钠和碳酸氢钠的混合溶液,不断测试 pH 值,直到 pH 值为 10.0 为止;添加8 mL比例为9:1的氯仿和异丙醇混合试剂,通过 16%的功率将温度提高到 40 ℃,持续 15 s,然后通过 12%功率将温度提高到 50 ℃,采用微波萃取法萃取 8 min,将样品罐放置直到与室温一致,最后将获取的溶液用离心管以离心率为 14000 r/min 离心 12 min。提取有机相,利用温度为 50 ℃的氮吹仪吹干,采用乙酸乙酯将残渣溶解,并定容到 60 μL,取出两个样品,通过 GC-FID 方法分析样品。
2 结果与讨论
2.1 液-液萃取条件优化
2.1.1 萃取溶剂
采用乙酸乙酯、氯仿、环乙烷和异丙醇各 8 mL 混合成溶剂,并且采用 1.2.3 小节方法处理样品。通过实验得到:当提取溶剂含有氯仿和异丙醇时,萃取率高,效果好,所以萃取溶剂设定为以 9:1 比例的氯仿和异丙醇溶液。
2.1.2 萃取率与温度的关系
将8 mL氯仿和异丙醇的混合试剂加入pH值已经分别调至 10、10.5 尿液和血液检测样品中,计算萃取率同温度的变化[11]。设定温度为 30 ℃、40 ℃、50 ℃ 和 60 ℃,当温度大于 40 ℃时,萃取率与温度成反比,所以最优的萃取温度为 40 ℃。
2.1.3 萃取时间
提取上述得到萃取溶剂 6 mL,即比例为 9:1 的氯仿和异丙醇的混合溶液,设定萃取温度为 40 ℃,萃取时间以 2 min 为基准,每隔 2 min 测试一次,其他的过程按 1.2.3 小节中的方法做样品前处理。通过实验得到:萃取效果根据萃取时间的增加[12],不断提高,但超过 10 min 后,效果变化不是很明显,因此最优萃取时间定为 10 min。
2.1.4 确准萃取溶剂用量
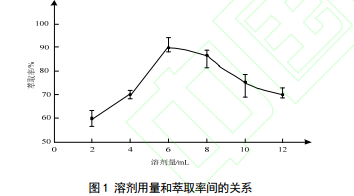
取 2 mL 上述得到的溶剂做萃取实验,然后依次增加 2 mL 分别做实验,设定萃取温度为 40 ℃,按照 1.2.3 小节中的方法做样品前处理,并持续 10 min。通过实验得到:萃取率会因为萃取溶剂用量的不同而发生显著的变化[13],但当溶剂超过 6 mL 时,萃取率不再升高,可以判定目标组分会因为溶剂过量而损耗并消失。因此设定 6 mL 为萃取效果最好的萃取溶剂。图 1 描述的是萃取率随着萃取溶剂的增加的变化曲线,可以看出随着溶剂量的提高,萃取率先提升后降低,最高萃取率是 90%,此时对应的溶剂量是 6 mL。
2.1.5 尿液与血液的 pH 值和违禁药品萃取的关系
温度设定为 40 ℃,通过体积比为 9:1 的氯仿和异丙醇混合溶液 6 mL 的萃取溶剂,实验时间定为 10 min,得到检测尿液和检测血液的 pH 值同违禁药品萃取率间的关系,见图 2。由图 2 可得,当 pH 值不断增加时,尿样和血样的萃取率不断的发生变化,当 pH 值为 10 时,尿样的萃取率达到最高 85%,当 pH 值为 10.5 时,血样的萃取率达到最高 88%,因此采用 pH 值为 10 的尿液和pH 值为 10.5 的血样,可以获得最佳违禁药品萃取效果。主要原因是违禁药品和其代谢物都属于生物碱,当碱性较高时,违禁药品很容易被水解,导致萃取率降低,因此萃取违禁药品时尿液的 pH 值选择 10,血液的 pH 值选择 10.5。
2.2 GC-FID 色谱图分析
图 3 和图 4 描述的是采用 1.2.2 的色谱分析条件,基于2.1 小节的液-液萃取条件优化结果,采用GC-FID 方法获取人体食用运动营养食品后不同条件下检测尿液和血液色谱图。
分析图 3 和图 4 得出,在不同条件下采用 GC-FID 方法得到检测尿液中的 COC 和检测血液中的 COC、 EME 与基体干扰的分离效果明显,说明本文方法能够有效分离人体食用运动营养食品后尿液以及血液中的违禁药品和违禁药品代谢物,为违禁药品检测提供可靠分析依据。
2.3 违禁药品回收率和相对标准偏差
在检测尿液和血液中添加检测违禁药品的标准溶液,分别调制质量浓度是 0.6 μg/mL,1.2 μg/mL,2.2 μg/mL 的尿液和血液样品各 8 份,实施 GC-FID 分析,运算目标组分的峰面积同一致浓度标准溶液的峰面积比例值,该比例值则是食用运动营养食品后人体血液和尿液中违禁药品的回收率和相对标准偏差,结果分别用表 1 和表 2 描述。
分析表 1 和表 2 得出,随着违禁药品标准溶液质量浓度的逐渐增加,检测出检测尿液的最高平均回收率为 96.73%,检测血液的最高平均回收率为 98.43%,相对标准偏差均小于 1.7%,对应的相对标准偏差最小值分别为 1.32%和 1.46%,说明采用本文方法检测食用运动营养食品后人体尿液和血液中违禁药品具有较高的回收率,并且平均最小相对标准偏差是 1.39%,检测违禁药品准确率高,在实际应用中有很好的效果,为检测尿液和血液中的违禁药品提供了支撑。
2.4 血液中违禁药品检测相对标准偏差
将COC 和EME 配制成混合标准溶液添加到检测血液样本中,调配成质量浓度分别是 0.4、1.8、3.0 和 4.0 mg/L 的样本的 COC 和 EME 组分,两种组分在日内和日间的样品分别是 6 份和 3 份,一天内检测 5 次相对标准偏差,连续 3 天检测相对标准偏差,结果如表 3 所示。
分析表 3 得到,人体中 COC 和 EME 的日内和日间相对标准偏差会随着加入量的增加而降低,日内 COC 和 EME 的平均相对标准偏差分别是 1.85%和 2.23%,日间 COC 和 EME 的平均相对标准偏差分别是 1.96%和 2.23%,说明本文方法检测违禁药品时可以获得很好的分离效果;本文方法检测人体食用运动营养食品后日内和日间血液中EME和COD的平均相对标准偏差均低于 2.3%,说明本文方法可以准确检测出运动营养食品食用人体血液中的违禁药品。
3 结论
采用本文方法检测尿液和血液中的违禁药品,回收率最高达到 96.73%和 98.43%,说明采用本文方法检测违禁药品准确性好,回收率高。主要是因为本实验采用的仪器都是精密仪器,并且本文方法所用的溶液都是通过多次配比得到的标准溶液。通过本文方法检测在检测血液中加入的 COC 和 EME 的混合溶液时,得到 COC 和 EME 的相对标准偏差不同,当加入违禁药品标准溶液质量浓度增加时,提取的 COC 和 EME 的相对标准偏差越低,说明本文方法检测血液中 COC 和 EME 时受基体的干扰小。本文通过液-液萃取-气相色谱法检测尿液和血液中的违禁药品以及代谢物 EME,利用精密的仪器,标准的溶剂,并对检测尿液和血液样品细致的处理优化萃取条件,进而采用 GC-FID 方法准备检测出食用运动营养食品后人体体内违禁药品以及其代谢物,对于预防违禁药品滥用、提高运动营养食品安全性具有重要的参考价值。
参考文献
[1] 刘志远,匡明.枸杞五味子汁复合运动饮料的研制[J].吉林农业科技学院学报,2015,24(1):5-7 LIU Zhi-yuan, KUANG Ming. On the development of compound Schisandra chinensis-wolfberry juice sports drink [J]. Journal of Jilin Agricultural Science and Technology College, 2015, 24(1): 5-7
[2] 马永轩,张名位,魏振承,等.运动营养食品的现状与趋势[J]. 食品研究与开发,2017,38(14):205-207 MA Yong-xuan, ZHANG Ming-wei, WEI Zhen-cheng, et al. Current status and development trends of sports foods [J]. Food Research and Development, 2017, 38(14): 205-207
[3] 王路娜,陈一冰,张均,等.违禁药品-苯丙胺调节转录肽对缺血 -再灌注模型小鼠皮质突触可塑性的影响[J].中国脑血管病杂志,2017,14(3):127-132 WANG Lu-na, CHEN Yi-bing, ZHANG Jun, et al. Effect of cocaine and amphetamine-regulated transcript peptides on cortical synaptic plasticity in the model mice of ischemia-reperfusion injury [J]. Chinese Journal of Cerebrovascular Diseases, 2017, 14(3): 127-132
运动营养食品中违禁药品的检测相关论文期刊你还可以阅读:《食品药品类论文发表渠道》
转载请注明来自:http://www.lunwenhr.com/hrlwfw/hryxlw/11367.html